
Cells │揭示ZmMs33/ZmGPAT6通过影响活性氧和物质代谢稳态调控玉米雄性发育
活性氧和物质代谢稳态在植物生长和发育过程中发挥重要作用。花药发育和花粉形成过程中,活性氧和能量水平失衡都可导致植物雄性不育,但其具体机制仍不完全清楚。玉米中,ZmMs33/ZmGPAT6基因编码一个甘油-3-磷酸酰基转移酶,其功能缺失突变体表现严重的雄性不育表型,包括花药伸长停滞、花药壁四层结构发育缺陷、小孢子外壁发育缺陷和无成熟花粉粒产生等[1-4]。这些结果暗示ZmMs33/ZmGPAT6基因功能缺失可能在代谢和生理水平上扰乱整个花药的正常发育,最终导致完全的雄性不育表型。

2022年07月28日,北京科技大学生物与农业研究中心、北京中智生物农业国际研究院万向元教授团队在国际期刊cells(IF: 7.666)上在线发表了题为“The Loss-Function of the Male Sterile Gene ZmMs33/ZmGPAT6 Results in Severely Oxidative Stress and Metabolic Disorder in Maize Anthers”的研究论文。该文通过玉米花药发育多时期比较转录组学分析,结合细胞学、生理学和分子生物学实验研究,揭示了ZmMs33/ZmGPAT6基因功能缺失突变体(ms33-6038)花药中活性氧(ROS和·OH)水平提高,引起花药严重氧化胁迫反应和物质能量代谢重排;活性氧产生和清除通路、氧化胁迫信号转导通路、代谢稳态和胁迫应答通路中关键基因的表达都发生显著变化,且在已比较的6个玉米细胞核雄性不育(GMS)品系中,这些基因的表达变化程度在ms33-6038花药中最大;ms33-6038突变体中的氧化胁迫和物质能量代谢重排,进一步导致大部分已报道的玉米GMS基因在ms33-6038花药发生转录水平的重排。这些结果表明ZmMs33/ZmGPAT6基因功能缺失,引起花药氧化胁迫反应、代谢重排和众多GMS基因转录重排,最终导致ms33-6038花药表现严重的过早凋亡和完全雄性不育表型。
首先,该研究通过比较分析ms33-6038及野生型花药六个时期(S5到S9)的转录组数据发现,在后三个时期(S8a、S8b和S9)突变体花药中,胁迫应答基因显著上调表达,物质代谢基因显著下调表达,暗示突变体雄性不育与胁迫应答和代谢紊乱有关。进一步分析发现,与野生型花药相比,突变体花药中含氧化合物应答基因表达显著上调,活性氧水平和羟自由基(ROS和·OH)水平显著升高(图1);产生活性氧的NADPH途径、脂肪酸β氧化途径、支链氨基酸降解途径上的基因表达上调,清除活性氧的过氧化物酶循环和WWC循环(water-water cycle)中的基因表达下调;介导氧化胁迫反应的MAPK信号途径上的基因表达上调(图2)。这些结果表明,ZmMs33/ZmGPAT6基因功能缺失,影响花药中脂肪酸和氨基酸等物质和活性氧代谢,导致活性氧大量的积累,引起严重的氧化胁迫反应。
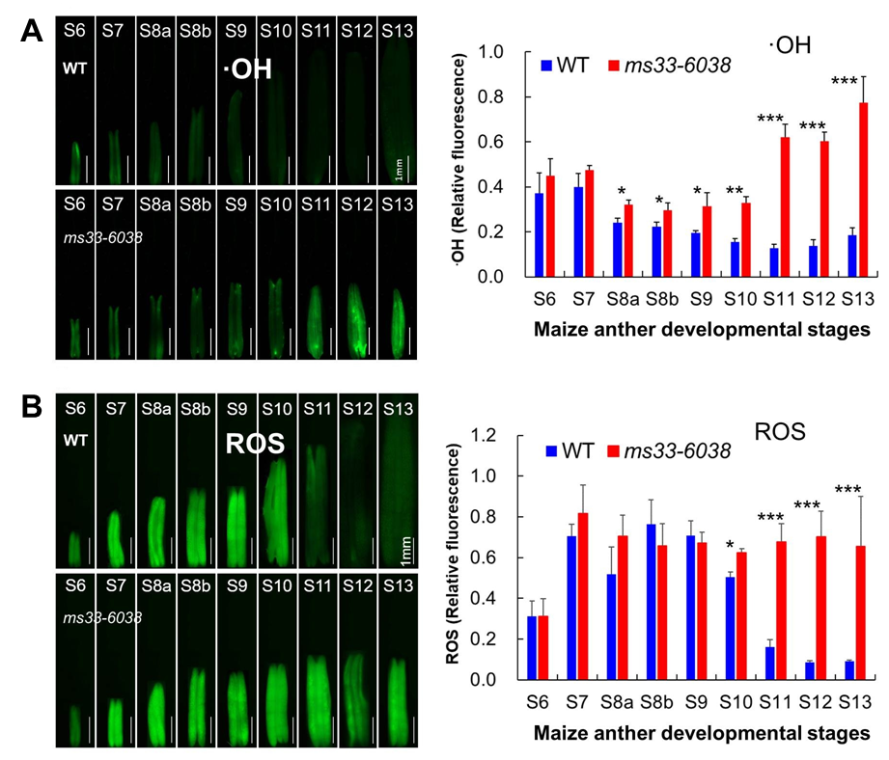
图1:ZmMs33/ZmGPAT6基因功能缺失导致花药中羟自由基(A图)和活性氧(B图)的过量积累
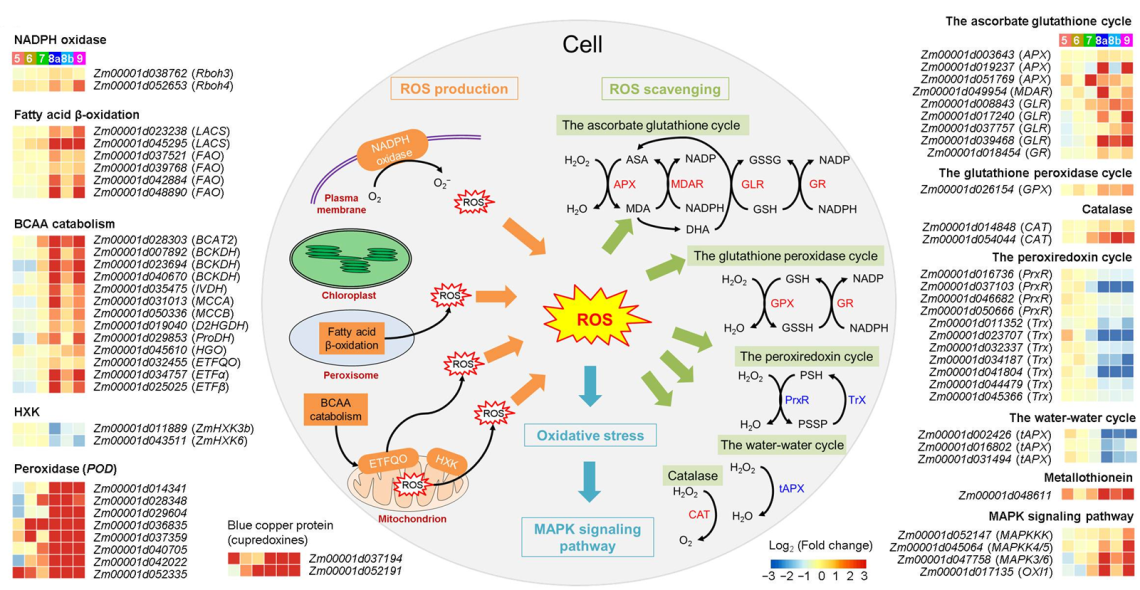
图2:ZmMs33/ZmGPAT6基因功能缺失导致花药中活性氧代谢和氧化胁迫应答通路相关基因的表达变化
然后,针对活性氧产生和清除途径以及氧化胁迫应答途径上的64个相关基因,通过与玉米中已有花药多个发育时期转录组数据的5个GMS不育系材料(包括ocl4、ms23、mac1、ms30-6028和p5126-ZmMs7)进行比较,发现只有ms33-6038花药中的这些基因表现出广泛的表达水平变化。这一结果表明,在花药发育过程中,ZmMs33/ZmGPAT6基因在影响活性氧和物质代谢稳态功能上具有特异性。
最后,针对ms33-6038由于活性氧过早积累导致花药绒毡层细胞过早凋亡和严重自噬,分析了除SnRK1基因之外的影响物质代谢稳态和胁迫应答的关键调控基因。结果发现,TOR途径、PYL-PP2AC途径和SnRK2途径上的基因表达明显变化(图3),与突变体中降低的合成代谢水平以及升高的分解代谢和胁迫应答水平相一致。另外,20个已报道的玉米GMS基因在ms33-6038花药中的表达水平发生显著改变,包括11个转录因子基因,8个脂代谢相关基因和1个糖代谢相关基因。这些结果表明ms33-6038花药中的氧化胁迫和代谢重排,与TOR、PYL、PP2AC和SnRK2基因功能相关,且引起大部分玉米雄性不育基因表达水平显著变化。
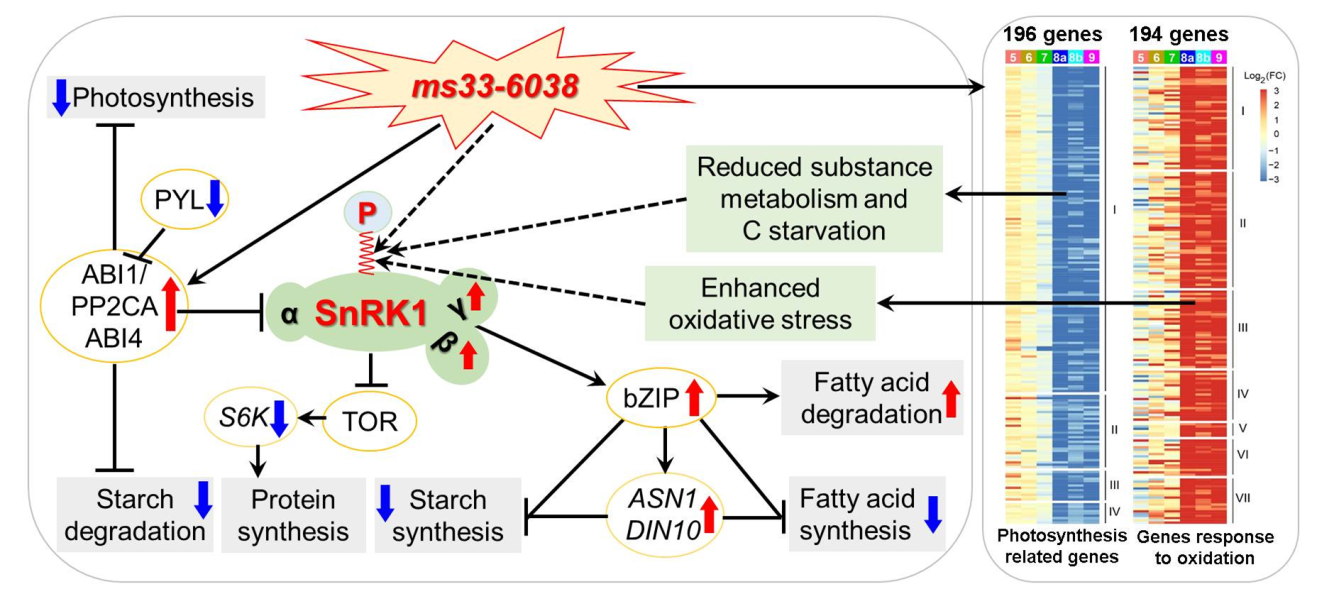
图3:ZmMs33/ZmGPAT6基因功能缺失导致花药中物质代谢稳态关键调控基因表达变化
总之,通过本研究,发掘出ZmMs33/ZmGPAT6基因功能缺失突变体是研究活性氧和物质代谢稳态与植物雄性育性关系的一个理想材料,揭示出氧化胁迫和代谢重排是导致ms33-6038花药严重缺陷和完全雄性不育表型的重要原因之一,表明了ZmMs33/ZmGPAT6基因在调控花药活性氧和物质代谢稳态中的重要功能,拓展了对花药发育过程中脂代谢与活性氧稳态间功能联系的理解,有助于深入解析玉米雄性不育的分子机理。此文也是北京科技大学万向元团队在研究ZmMs33/ZmGPAT6基因功能机理的第四篇论文,前三篇分别发表在Theor. Appl. Genet. 2018, 131, 1363-1378;Theor. Appl. Genet. 2019, 132, 2137-2154;Mol. Plant 2020, 13, 1624-1643(封面文章)。
北京科技大学生物与农业研究中心青年教师李紫文博士、博士生柳双双和博士后朱涛涛为该文的共同第一作者,龙艳教授和万向元教授为该文的共同通讯作者。
原文链接:https://www.mdpi.com/2073-4409/11/15/2318
参考文献:
1. Xie, K.; Wu, S.; Li, Z.; Zhou, Y.; Zhang, D.; Dong, Z.; An, X.; Zhu, T.; Zhang, S.; Liu, S., et al. Map-based cloning and characterization of Zea mays male sterility33 (ZmMs33) gene, encoding a glycerol-3-phosphate acyltransferase. Theor. Appl. Genet. 2018, 131, 1363-1378.
2. Zhang, L.; Luo, H.; Zhao, Y.; Chen, X.; Huang, Y.; Yan, S.; Li, S.; Liu, M.; Huang, W.; Zhang, X., et al. Maize male sterile 33 encodes a putative glycerol-3-phosphate acyltransferase that mediates anther cuticle formation and microspore development. BMC Plant Biol. 2018, 18, 318.
3. Zhu, T.; Wu, S.; Zhang, D.; Li, Z.; Xie, K.; An, X.; Ma, B.; Hou, Q.; Dong, Z.; Tian, Y., et al. Genome-wide analysis of maize GPAT gene family and cytological characterization and breeding application of ZmMs33/ZmGPAT6 gene. Theor. Appl. Genet. 2019, 132, 2137-2154.
4. Zhu, T.; Li, Z.; An, X.; Long, Y.; Xue, X.; Xie, K.; Ma, B.; Zhang, D.; Guan, Y.; Niu, C., et al. Normal structure and function of endothecium chloroplasts maintained by ZmMs33-mediated lipid biosynthesis in tapetal cells are critical for anther development in maize. Mol. Plant 2020, 13, 1624-1643.


