
Molecular Plant|后杂种优势利用时代有望利用显性核不育技术提高作物籽粒产量
据预测到本世纪中叶,全球人口将达到100亿。全球人口不断增长的同时,还面临耕地资源和淡水资源的短缺、以及全球变暖等造成的多种生物和非生物胁迫,全球粮食安全正受到前所未有的严峻挑战(Hickey et al., 2019)。上世纪由于半矮秆等绿色革命基因和双交种、单交种等杂种优势的应用,分别导致了第一次和第二次绿色革命,促使玉米和水稻等主要粮食作物大幅度增产,为保障全球粮食安全做出了重要贡献(图1A,B)。但进入本世纪后,全球粮食增产速度趋缓,部分作物的单产甚至停滞不前,意味着以种植杂交种为主的作物生产进入了后杂种优势利用时代。后杂种优势利用时代的主要标志是传统杂种优势利用方法的增产潜力已趋于饱和,亟待分子育种、生物育种、设计育种、基因编辑、合成生物学等新育种技术的综合应用。
植物雄性不育技术,尤其是以质核互作为基础的“三系法”和以光温敏不育为基础的“两系法”曾经在水稻等作物的杂种优势利用中,发挥了十分重要的作用。其中,由“三系法”衍生的玉米细胞质不育杂交种与正常可育杂交种混合种植、或人工拔出部分玉米可育杂交种的雄穗,由于不育杂交种的雄穗发育缺陷或人工干预其发育可以节约雄穗发育所需要的物质能量,使得光合产物和能量可以更多地分配到雌穗发育中,从而导致玉米杂交种籽粒增产(Munsch et al., 2010; Gao et al., 2020; Weingartner et al., 2002)。类似,由玉米显性不育系Ms44配制的杂交种与可育杂交种混合种植,也可以提高玉米杂交种氮肥利用率并增产,尤其是在低氮、干旱等逆境条件下增产效果更明显(Fox et al., 2017; Loussaert et al., 2017)。此外,万向元团队利用前期克隆的玉米育性关键转录因子ZmMs7(Zhang et al., 2018)的异时表达(p5126-ZmMs7M),建立了一种适应于多种植物(如玉米、水稻和拟南芥)的显性核不育技术体系(DGMS)(An et al., 2020,PNAS)。
据此,万向元团队提出了后杂种优势利用时代有望利用显性核不育技术提高作物籽粒产量的观点,并于2021年02月11日在线发表于Molecular Plant(Wan et al., 2021)。

如前所述,后杂种优势利用时代需要综合应用多种现代育种技术手段,通过多基因/多性状聚合,创制高产优质、绿色高效、综合性状优异的超级杂交种,从而保障全球粮食安全和农业可持续发展。在此基础上,万向元团队提出,通过显性雄性不育基因/性状与多种现代育种技术相结合,有望打造一种新型的作物(尤其是玉米等异交授粉作物)育种、制种和生产模式,提高作物显性不育F1杂交株的籽粒产量(图1C-E)。其主要原理是:由于显性核不育技术生产的显性不育系在不育位点上为杂合子,用其作为母本生产的杂交种有约50%的显性不育杂交种和约50%的可育杂交种。二者混合种植,其中一半的不育杂交F1植株可以被可育杂交F1植株充分授粉而雌穗(果穗)正常结实。同时,由于不育F1杂交株的雄性器官(花药和花粉)发育受阻而节约的物质和能量可以有效地分配到雌穗(果穗)中,从而导致50%不育株玉米籽粒产量增加(图1E)。
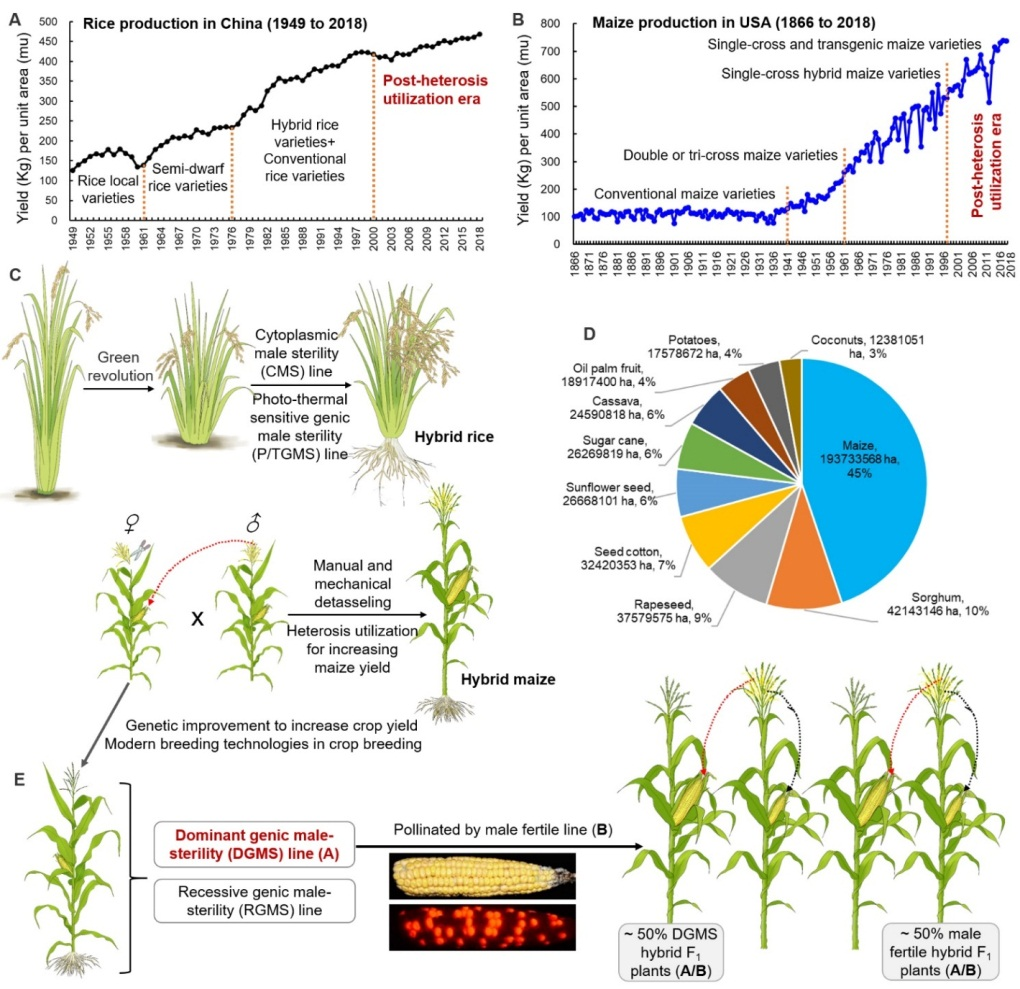
图1:显性核不育技术在后杂种优势利用时代有望提高作物产量的应用模式
显性核不育技术相对于隐性核不育技术(如玉米多控不育MCS技术,Zhang et al., 2018, PBJ; An et al.,2019, MP;SPT技术:Wu et al., 2016, PBJ)、三系法和两系法而言,具有以下优势:(1)显性核不育技术不仅具备隐性核不育技术的优点以用于杂交育种和制种,同时利用约50%不育F1杂交株而提高异交授粉作物的籽粒增产;(2)显性核不育技术产生的不育杂交种和可育杂交种不需要分选,而直接随机混合种植;(3)显性不育杂交种由于没有花粉产生,不会造成转基因花粉漂移,如与其它转基因性状(如抗虫、抗除草剂等)聚合,生态环境相对更安全(Munsch et al., 2010);(4)显性核不育系还可以用于大规模的轮回选择育种,以高效聚合多种优异基因/性状(如高产、抗病和抗逆等)。总之,将显性核不育基因/技术与多种现代育种技术相结合,有望引发异花授粉作物一种新的种植模式,即50%不育杂交种与50%可育杂交种混合种植,进一步提高作物籽粒产量,在后杂种优势利用时代为保障全球粮食安全和农业可持续发展做出贡献。
此外,关于玉米显性核不育技术,万向元团队于2020年获授权国家发明专利3项(201811449084.1;201811450364 .4;201811451837.2)。
原文链接:https://www.cell.com/molecular-plant/fulltext/S1674-2052(21)00050-2
参考文献:
1. An, X., et al. (2019). ZmMs30 Encoding a Novel GDSL Lipase Is Essential for Male Fertility and Valuable for Hybrid Breeding in Maize. Mol Plant 12: 343-359.
2. An, X., et al. (2020). Molecular regulation of ZmMs7 required for maize male fertility and development of a dominant male-sterility system in multiple species. Proc Natl Acad Sci U S A 117: 23499-23509.
3. Fox, T., et al. (2017). A single point mutation in Ms44 results in dominant male sterility and improves nitrogen use efficiency in maize. Plant Biotechnol J 15: 942-952.
4. Gao, Z., et al. (2020). Detasseling increases kernel number in maize under shade stress. Agricultural and Forest Meteorology 280: doi: 10.1016/j.agrformet.2019.107811.
5. Hickey, L.T., et al. (2019). Breeding crops to feed 10 billion. Nat Biotechnol 37: 744-754.
6. Loussaert, D., et al. (2017). Genetic Male Sterility (Ms44) Increases Maize Grain Yield. Crop Science 57: 2718-2728.
7. Munsch, M.A., et al. (2010). Grain Yield Increase and Pollen Containment by Plus-Hybrids Could Improve Acceptance of Transgenic Maize. Crop Science 50: 909-919.
8. Wan X., et al. (2021). Breeding with Dominant Genic Male-Sterility Genes to Boost Crop Grain Yield in Post-Heterosis Utilization Era. Mol. Plant. doi: https://doi.org/10.1016/j.molp.2021.02.004.
9. Wu, Y., et al. (2016). Development of a novel recessive genetic male sterility system for hybrid seed production in maize and other cross-pollinating crops. Plant Biotechnol J 14:1046-1054
10. Weingartner, U., et al. (2002). Combining Cytoplasmic Male Sterility and Xenia Increases Grain Yield. Crop Science 42: 1848-1856.
11. Zhang, D., et al. (2018). Construction of a multicontrol sterility system for a maize male-sterile line and hybrid seed production based on the ZmMs7 gene encoding a PHD-finger transcription factor. Plant Biotechnol J 16: 459-471.


