
The Crop Journal│揭示茉莉酸介导的胁迫应答与雄性不育间共享机制
生物和非生物胁迫影响植物生长和发育。植物雄性发育是一个被精准调控的发育过程,易受环境胁迫影响,进而影响作物产量。植物激素信号传导途径调控植物正常生长发育过程和对外部胁迫的应答反应。然而,目前我们对植物激素信号途径、胁迫应答反应以及雄性发育过程间的相互作用机制仍知之甚少。ms33-6038是一个ZmMs33/ZmGPAT6基因功能缺失的玉米雄性不育突变体[1,2]。之前研究表明,ms33-6038突变体花药内皮层叶绿体正常功能丧失且绒毡层细胞表现严重的细胞自噬[3],花药减数分裂后发生伸长停滞[4],花药中活性氧过量积累且表现出比其它雄性不育突变体花药更严重的氧化胁迫反应[5]。因此,ms33-6038突变体为解析雄性不育与胁迫应答间的关联,提供了很好的实验材料。
2023年06月29日,北京科技大学、北京中智生物农业国际研究院万向元教授团队在The Crop Journal (IF: 6.6)在线发表了题为“Jasmonic acid-mediated stress responses share the molecular mechanism underlying male sterility induced by deficiency of ZmMs33 in maize”的研究论文,作者以玉米雄性不育突变体ms33-6038的花药为研究对象,运用跨物种比较转录组学分析和生化分子实验,对植物雄性不育与胁迫应答间的关联进行研究,发现一个由茉莉酸(Jasmonic acid,JA)介导的环状调控通路ZmMs33-JA-WRKY-ZmMs33在玉米雄性不育和JA介导的胁迫应答中起CROSSTALK作用,揭示ZmMs33基因同时控制玉米雄性不育和应答逆境胁迫的功能。

首先,该研究收集了五种植物(拟南芥、水稻、玉米、小立碗藓和衣藻)在生物胁迫和九类非生物胁迫(高温、低温、光照、干旱、盐、植物激素、营养缺乏、重金属和其他化合物胁迫)条件下的转录组数据149套,包含514个转录组文库(图1A)。比较转录组分析发现,在35套胁迫相关的玉米转录组数据中,与ms33-6038花药转录组基因表达变化最相似的前三个胁迫条件均是严重干旱处理(图1B),表明ms33-6038花药转录组变化与严重干旱胁迫相关。先前研究中,鉴定出与ms33-6038突变体花药表型变化紧密联系的376个差异表达基因[3–5]。本研究中,通过分析这些基因的拟南芥和水稻同源基因在胁迫处理转录组中的表达变化,发现与ms33-6038突变体花药表达变化最相似的拟南芥和水稻胁迫条件仍是严重干旱处理(图1C)。这些结果表明,ZmMs33功能缺失引发花药发生类似于植物严重干旱胁迫下的转录组变化,同时暗示ZmMs33可能在玉米花药发育过程中参与胁迫应答。
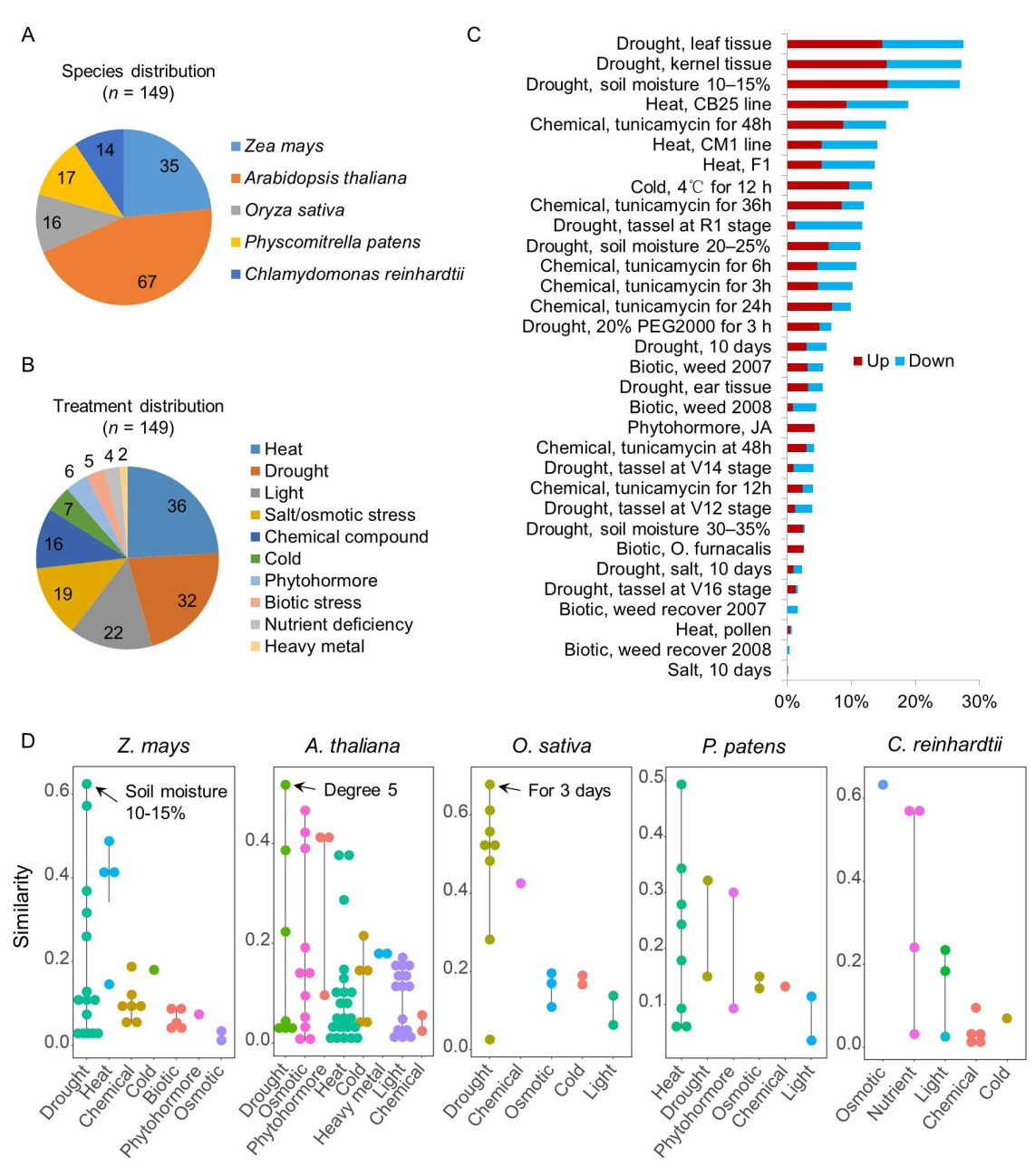
图1:ms33-6038突变体花药发生类似于植物严重干旱胁迫下的转录组变化
然后,通过比较ms33-6038突变体花药转录组与玉米叶片和雄穗干旱胁迫处理转录组,鉴定到2307个只在ms33-6038突变体花药中差异表达的基因,77个只在玉米叶片和雄穗干旱处理后差异表达的基因,以及707个在两者中都差异表达的基因(图2A)。基因功能富集分析表明,只在ms33-6038突变体花药中差异表达的基因和在两者中都差异表达的基因均富集于JA应答途径(图2B和C),暗示ms33-6038突变体花药中的转录重排可能与JA应答有关。此外,ms33-6038突变体花药和干旱胁迫转录组共享的下调基因功能富集于光合作用、碳水化合物合成和过氧化氢应答等(图2D到F)。植物激素含量测定结果表明,在花药发育的减数分裂和减数分裂后阶段,与野生型相比,ms33-6038突变体花药中JA含量显著升高(图3A)。转录组分析和基因表达qPCR验证表明,JA生物合成和信号传导基因,以及JA信号介导的干旱胁迫应答基因在ms33-6038突变体花药中表达上调(图3B到D)。这些结果表明,雄性不育基因ZmMs33影响花药发育过程JA稳态(ZmMs33-JA)。
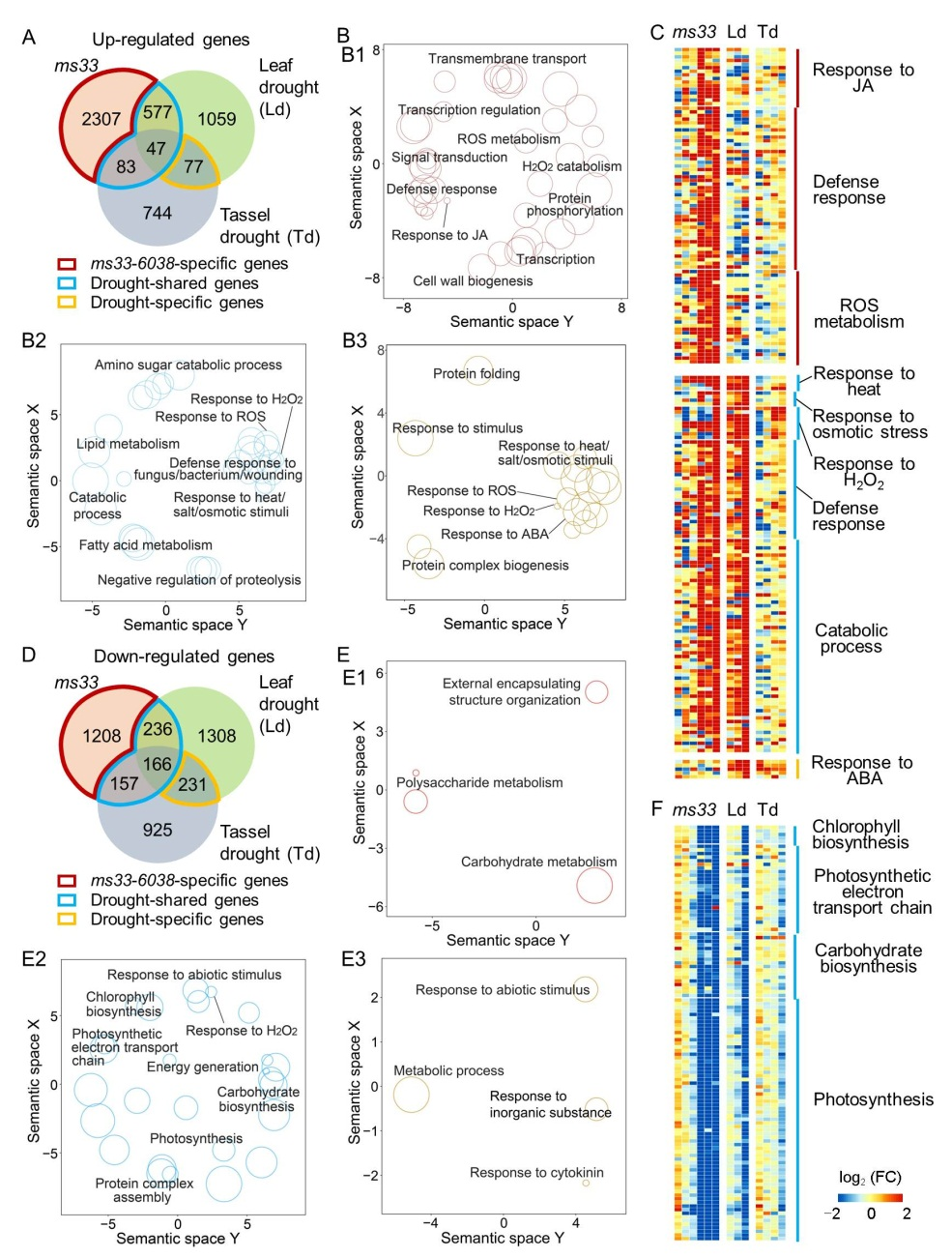
图2:ms33-6038突变体花药转录组变化与JA应答有关
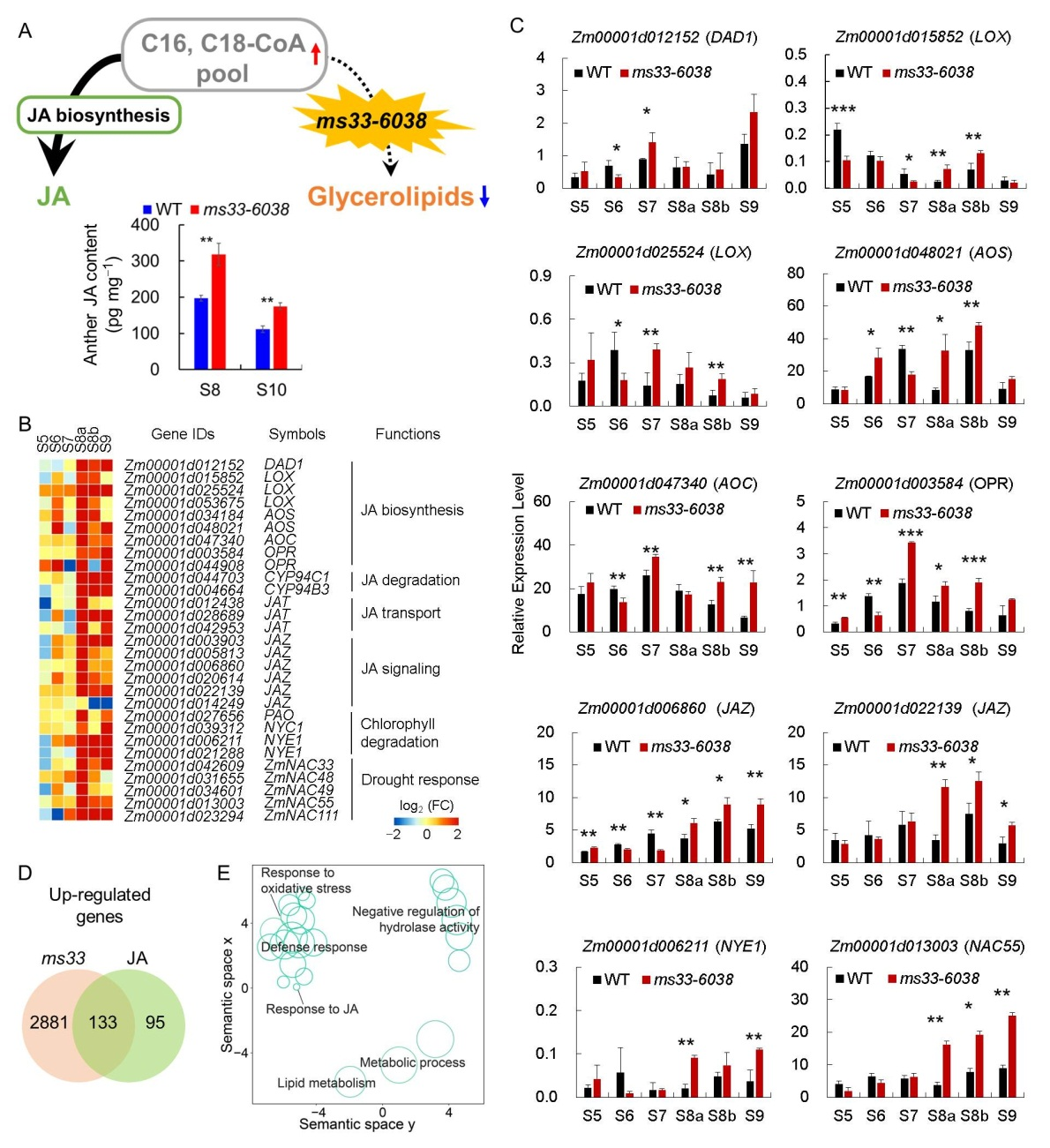
图3 ZmMs33影响花药发育过程JA稳态
最后,转录组分析和基因表达qPCR实验发现,外施JA可显著激活ZmMs33基因表达,并且ms33-6038突变体花药中ZmMs33突变基因的表达水平在花药发育的减数分裂之后时期也显著上升(图4A和B),表明ZmMs33可能是一个JA应答基因。通过基因共表达分析和启动子顺式调控元件分析,鉴定到三个应答JA且在ms33-6038突变体花药中显著上调表达的转录因子基因(图4C到F),可能介导JA引起的ZmMs33表达上调。启动子活性实验表明,其中一个基因(Zm00001d044162)编码的WRKY类转录因子可转录激活ZmMs33基因的启动子(图4G)。这些结果揭示出一条雄性不育基因ZmMs33应答JA的途径(JA-WRKY-ZmMs33)。
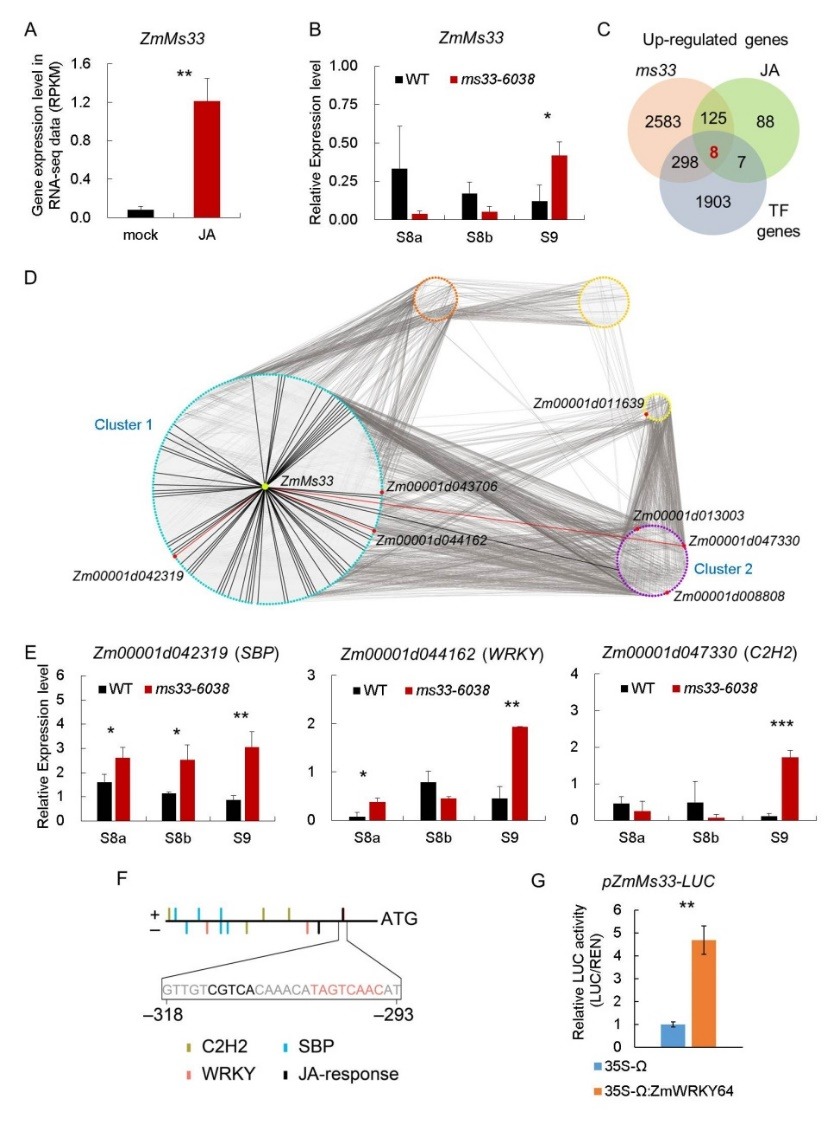
图4 ZmMs33通过一个WRKY类转录因子应答JA
总之,本研究发现了ZmMs33-JA-WRKY-ZmMs33这一环状调控通路,揭示出玉米雄性不育与JA介导的胁迫应答具有部分共享的调控机制(图5)。该成果为进一步研究植物激素稳态、雄性不育和胁迫应答间的相互作用提供了重要参考。
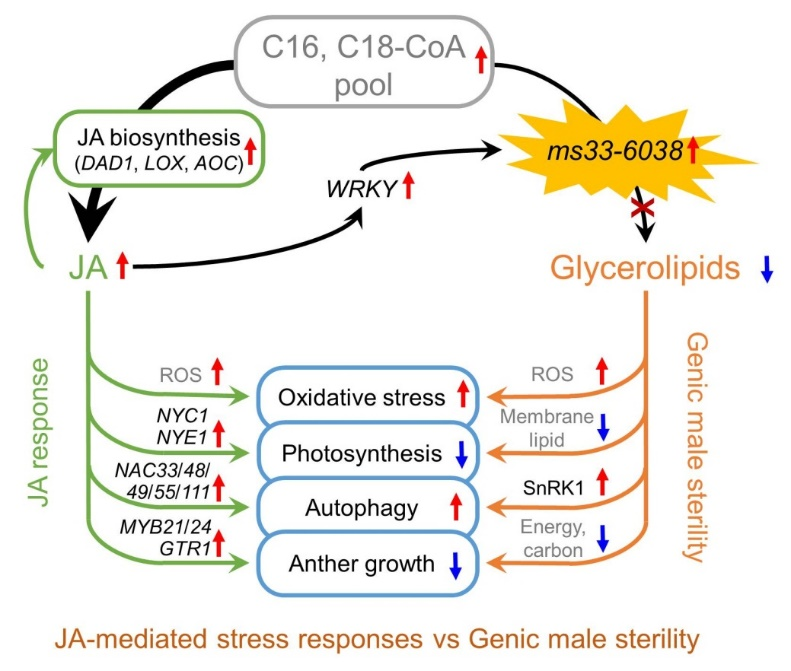
图5 ZmMs33-JA-WRKY-ZmMs33环状通路参与调控雄性不育和胁迫应答
此文也是北京科技大学万向元教授团队研究玉米ZmMs33/ZmGPAT6基因功能机理的第六篇论文,前五篇分别为Mol. Plant 2020, 13, 1624-1643(封面文章);Theor. Appl. Genet. 2018, 131, 1363-1378;Theor. Appl. Genet. 2019, 132, 2137-2154;Cells, 2022, 11, 2318;Crop Journal. 2023, 11, 361-373。
作者和基金项目
北京科技大学生物农业研究院李紫文副教授和博士生柳双双为该文共同第一作者,万向元教授为该文通信作者。该研究得到“十四五”国家重点研发计划项目(2021YFF1000302、2022YFF1003500、2022YFF1002400)、中央高校基本科研业务费(FRF-IDRY-20-038、06500136)以及国家自然科学基金(31971958)的支持。
原文链接:https://doi.org/10.1016/j.cj.2023.06.002
参考文献:
[1] K. Xie, S. Wu, Z. Li, Y. Zhou, D. Zhang, Z. Dong, X. An, T. Zhu, S. Zhang, S. Liu, J. Li, X. Wan, Map-based cloning and characterization of Zea mays male sterility33 (ZmMs33) gene, encoding a glycerol-3-phosphate acyltransferase, Theor. Appl. Genet. 131 (2018) 1363–1378.
[2] T. Zhu, S. Wu, D. Zhang, Z. Li, K. Xie, X. An, B. Ma, Q. Hou, Z. Dong, Y. Tian, J. Li, X. Wan, Genome-wide analysis of maize GPAT gene family and cytological characterization and breeding application of ZmMs33/ZmGPAT6 gene, Theor. Appl. Genet. 132 (2019) 2137–2154.
[3] T. Zhu, Z. Li, X. An, Y. Long, X. Xue, K. Xie, B. Ma, D. Zhang, Y. Guan, C. Niu, Z. Dong, Q. Hou, L. Zhao, S. Wu, J. Li, W. Jin, X. Wan, Normal structure and function of endothecium chloroplasts maintained by ZmMs33-mediated lipid biosynthesis in tapetal cells are critical for anther development in maize, Mol. Plant 13 (2020) 1624–1643.
[4] Z. Li, T. Zhu, S. Liu, L. Zhao, X. An, Y. Long, X. Wei, J. Zhang, Z. Dong, X. Wan, ZmMs33 promotes anther elongation via modulating cell elongation regulators, metabolic homeostasis, and cell wall remodeling in maize, Crop J 11 (2023) 361-373.
[5] Z. Li, S. Liu, T. Zhu, X. An, X. Wei, J. Zhang, S. Wu, Z. Dong, Y. Long, X. Wan, The loss-function of the male sterile gene ZmMs33/ZmGPAT6 results in severely oxidative stress and metabolic disorder in maize anthers, Cells 11 (2022) 2318.


