
Molecular Plant | 精准调控花粉外壁形成的“刹车分子”基因
花粉外壁是由孢粉素等精确组装的多层结构,因耐高温、防辐射、耐降解等特点,被称为植物界的“钻石”。花粉外壁在花粉传播过程中保护雄配子体,在花粉和柱头识别过程中具有重要作用,决定受精能否成功进而影响籽粒产量。花粉外壁发育缺陷导致的核雄性不育,可用于作物杂种优势利用,提高作物产量。因此,花粉外壁一直是国内外的研究热点。前人对花粉外壁图案形成提出了相分离和自组装模型[1,2]。然而,精确调控花粉外壁形成及厚度的分子机制仍然未知。
2023年7月26日,北京科技大学生物农业研究院、北京中智生物农业国际研究院万向元团队在Molecular Plant上发表了题为ZmMS1/ZmLBD30-orchestrated transcriptional regulatory networks precisely control pollen exine development的研究论文。

该研究利用上世纪30年代发现的第一个玉米雄性不育ms1突变体,经过11年努力,克隆了玉米花药特异表达的雄性不育基因ZmMs1(编码LBD转录因子ZmLBD30),借助ms1突变体花粉外壁异常变厚的独特表型(植物界之前发现的核雄性不育基因,都导致花粉外壁变薄),综合利用遗传学、细胞学、生物技术、分子生物学、蛋白生化、多组学等技术,揭示ZmMS1/ZmLBD30作为花粉发育中第一个发现的反馈调控抑制子(“刹车分子”),通过反馈抑制其上游的转录激活链,形成反馈抑制调控环ZmbHLH51-ZmMYB84-ZmMS7- ZmMS1/ZmLBD30,调节花药绒毡层PCD和降解的时长,确保花粉外壁的孢粉素适时和适量形成;最终破解了花粉外壁厚度精准形成的未解之谜,取得了花粉发育和雄性不育生物学研究领域的突破性进展。
该团队筛选利用花粉外壁异常增厚的玉米雄性不育突变体ms1-alb,克隆了ZmMs1/ZmLBD30基因,其在花药发育的单核小孢子(S9和S9-10)时期的绒毡层中特异表达。利用玉米花药特异启动子p5126驱动ZmMs1,创制了ZmMs1提前表达的遗传材料p5126-ZmMs1,发现早表达ZmMs1能导致玉米显性雄性不育。与野生型相比,ms1-alb花药绒毡层降解延迟而p5126-ZmMs1降解提前;ms1-alb花粉外壁显著增厚而p5126-ZmMs1明显变薄(图1)。因此,初步判断ZmMS1/ZmLBD30是绒毡层细胞降解和花粉外壁发育的一个负调控因子。
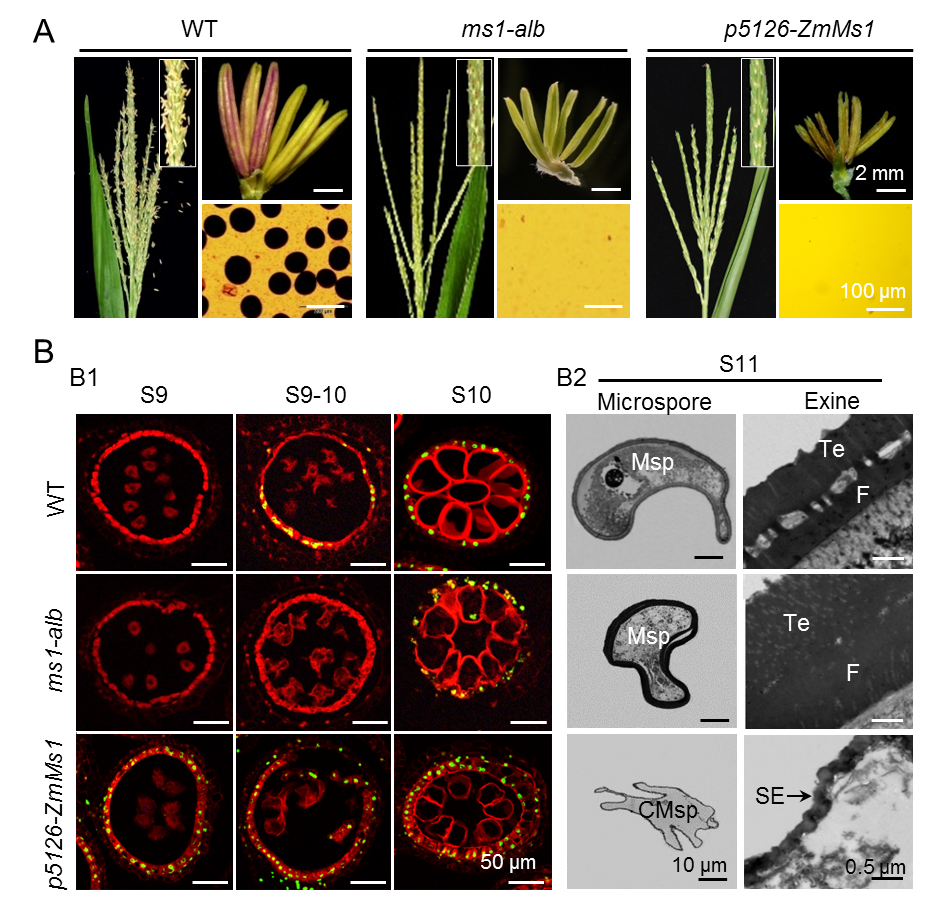
图1. ZmMS1/ZmLBD30调控花药绒毡层降解和花粉外壁厚度
玉米花药全时期转录组分析发现,本实验室之前报道的3个雄性不育转录因子基因ZmbHLH51、ZmMYB84和ZmMs7[3,4],在花药发育S9时期与ZmMs1有共同表达峰,qPCR及突变体遗传分析等表明ZmbHLH51、ZmMYB84和ZmMS7在花药发育进程中形成级联转录激活通路ZmbHLH51-ZmMYB84-ZmMS7,共同激活ZmMs1表达。Pro-LUC实验表明ZmMS1/ZmLBD30是转录抑制子,显著抑制ZmbHLH51、ZmMYB84和ZmMS7表达。SELEX实验揭示ZmMS1结合由13个碱基组成的CCGNNNNNNNCGG核心基序,而在ZmbHLH51、ZmMYB84和ZmMs7启动子上均包含该基序。ChIP-seq/qPCR、EMSA、突变体基因表达分析都显示ZmMS1/ZmLBD30直接结合这3个基因的启动子序列并抑制其表达。因此,ZmMS1受上游级联激活通路诱导表达后分别反馈抑制上游3个转录激活子,形成反馈抑制环ZmbHLH51-ZmMYB84-ZmMS7-ZmMS1(图2),ZmMS1/ZmLBD30被称为上游级联激活通路的“刹车分子”。该发现对花粉发育研究中报道的所谓“自抑制”现象提供了一种合理解释,如拟南芥AtMs1(ZmMs7同源基因)在atms1中的上调表达型[5];本研究ZmMYB84在myb84突变体中表达上调,ZmMs7在ms7突变体中表达上调,因为myb84和ms7突变,不能激活翻译下游反馈抑制子ZmMS1,进而缺少对ZmMYB84和ZmMs7转录抑制,导致ZmMYB84和ZmMs7表达上调。这是本研究发现的最大亮点之一。
进一步分析发现孢粉素合成、转运相关ZmMs26、ZmABCG26等6个代表基因以及ROS清除相关ZmPODa等3个代表基因在ms1-alb中上调,而在p5126-ZmMs1中显著下调。ChIP-Seq及体外表达调控分析均表明,这些基因直接受ZmMS1抑制或直接受ZmMYB84、ZmMS7激活进一步被ZmMS1间接抑制。据此,ZmMS1/ZmLBD30分子调控机逐渐明析:在ms1-alb突变体中,一方面孢粉素合成、转运相关基因不能及时被抑制而产生过量的孢粉素;另一方面ROS清除基因不能及时被抑制,ROS含量不足以引发绒毡层PCD而导致绒毡层延迟降解,进而为合成更多的花粉外壁形成所需物质提供场所和时间,最终导致ms1-alb花粉外壁变厚。反之,提前表达ZmMs1则导致花粉外壁变薄(图2)。ZmMs1在花粉发育至游离小孢子期被原本促进花粉外壁形成的ZmbHLH51-ZmMYB84-ZmMS7转录激活链激活表达,尽管ZmMS1表达的时间窗口非常窄,但ZmMS1蛋白一旦形成,立即开始同时反馈抑制ZmbHLH51、ZmMYB84 和ZmMs7基因表达,促进启动绒毡层PCD和降解并关闭孢粉素合成、转运等相关基因表达。因此,ZmMS1/ZmLBD30作为“刹车分子”及时高效终止花粉外壁物质的过度供应,平衡花粉外壁形成的适度时长和物质供应,确保外壁的正常厚度,体现了生命体精准调控的神奇魅力。这是本研究发现的又一大亮点。
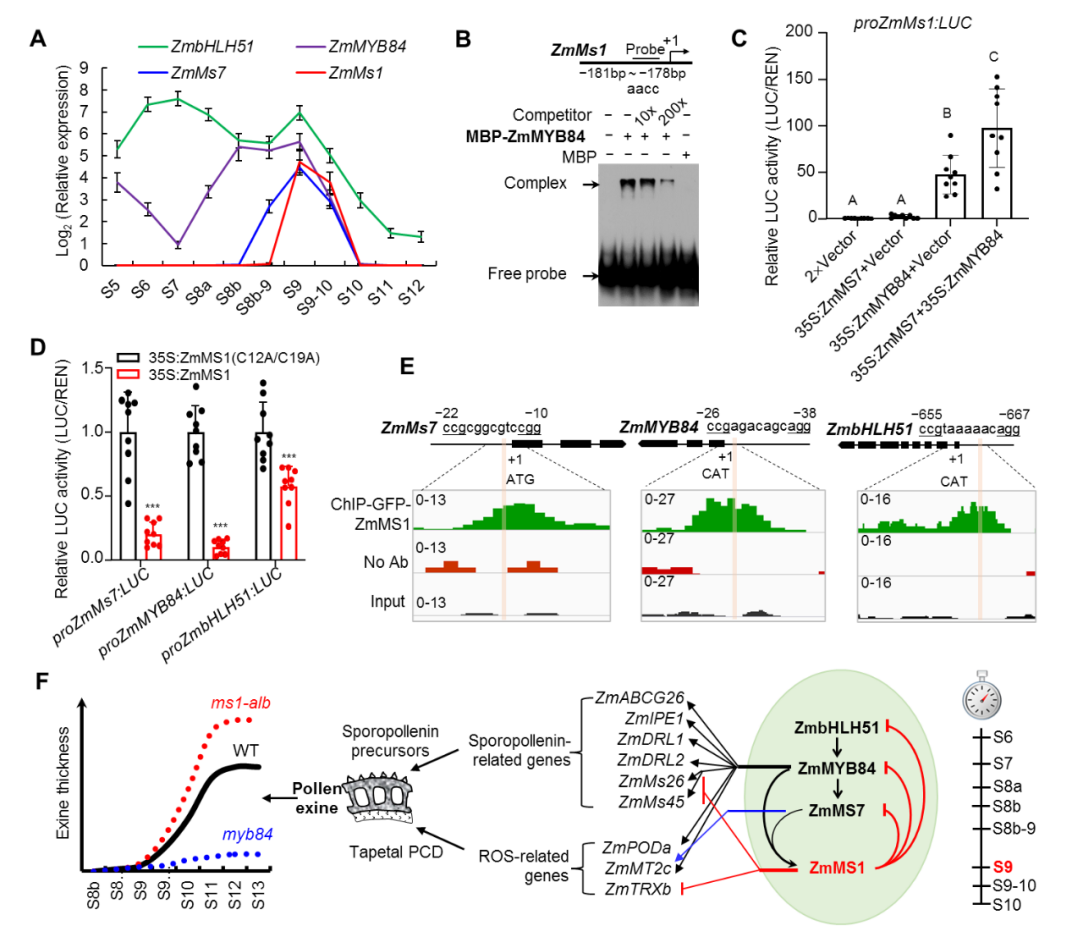
图2. ZmMS1/ZmLBD30反馈抑制上游转录激活子ZmbHLH51、ZmMYB84和ZmMS7精确调控花粉外壁形成
最后,对ZmMs1在开花植物中的进化保守性进行了探索。共线性和序列比对分析表明,在玉米进化亲缘关系较近的高粱、南荻中存在ZmMs1同源基因,且高粱中的同源基因可形成类似的反馈抑制环SbbHLH51-SbMYB84-SbMS7-SbMS1。但在进化关系较远的植物中则缺失ZmMs1同源基因,例如水稻和拟南芥ZmMs1序列比对分值最高的基因敲除后均雄性可育。但是,ZmbHLH51、ZmMYB84和ZmMS7在水稻和拟南芥中的同源蛋白可形成类似的级联激活通路OsTDR1-OsMYB80-OsPTC1和AtAMS-AtMS188-AtMS1,且这些同源基因的表达在水稻、小麦、拟南芥游离小孢子期之后均迅速下调,暗示可能存在类似于玉米ZmMS1 “刹车分子”。据此推测可能在水稻、拟南芥等植物中其它LBD基因发挥类似于ZmMs1的功能。通过两个物种中LBD家族转录抑制子筛选,分别找到花药表达的转录抑制子OsLBD37-like和AtLBD42,二者对OsTDR1-OsMYB80-OsPTC1和AtAMS-AtMS188-AtMS1激活通路分别具有抑制作用。利用水稻、拟南芥自身p5126启动子驱动的pOs5126-OsLBD37-like和pAt5126-AtLBD42转基因水稻和拟南芥,均表现出显性雄性不育,表型与p5126-ZmMs1转基因玉米一致(图3),表明水稻和拟南芥中也存在类似于玉米中ZmMS1/ZmLBD30主导的反馈抑制调控通路。因此,本研究的发现在不同植物中具有普适性,为相关领域科研工作者未来深入解析花药和花粉发育的分子机制提供新的设计思路。这也是本研究发现的一大亮点。
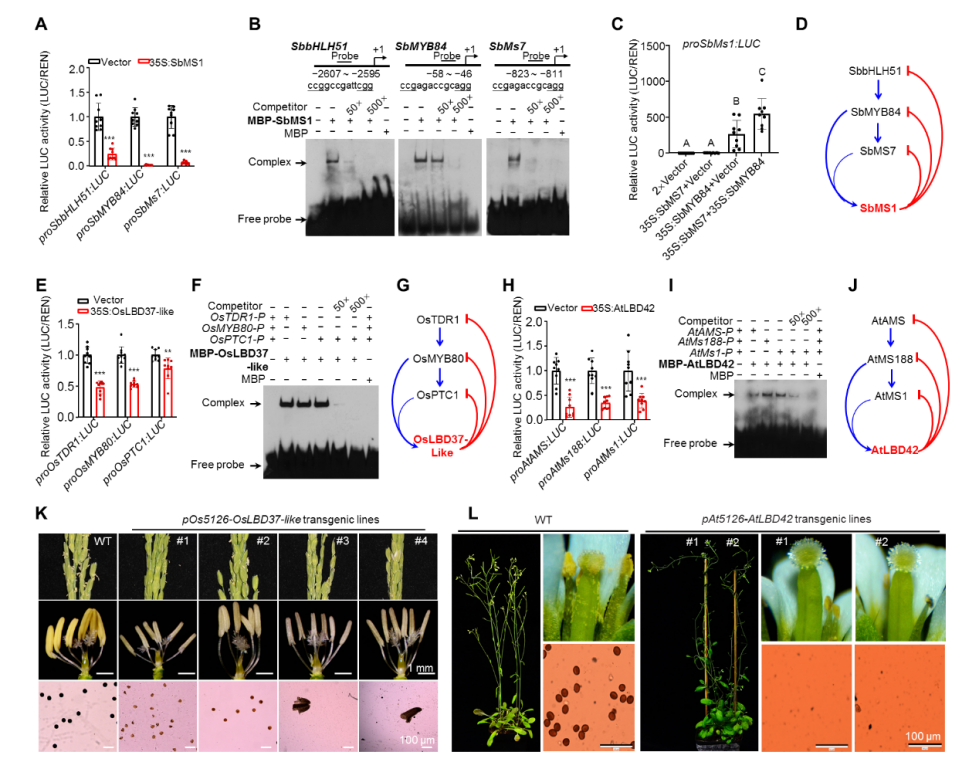
图3. ZmMS1/ZmLBD30在开花植物中的功能保守性及进化分析
综上,本研究成功克隆了玉米中第一个发现的雄性不育突变体的ZmMs1基因,是迄今为止在研究植物花药花粉发育过程中发现的第一个“刹车分子”,其主导的反馈抑制调控网络揭示了花粉外壁精准形成的奥秘,同时为全球许多实验室在研究花药花粉发育中质疑的“激活子基因自抑制表达的现象”提供了一个合理解释的工作模型,为构建植物雄性发育全时期的分子调控网络全局图迈出了里程碑的一步,是植物雄性生殖发育研究领域的重大突破。
北京科技大学生物农业研究院侯全璨、安学丽、马彪、吴锁伟和魏珣为该论文共同第一作者,万向元为通讯作者。山东农业大学付道林、倪飞以及上海师范大学杨仲南参与了该项工作。该研究得到了“十四五”国家重点研发计划、国家自然科学基金、中央高校基本科研业务费、北京市科技新星等项目的资助。
参考文献
1、Radja, A.; Horsley, E.M.; Lavrentovich, M.O. and Sweeney, A.M. Pollen cell wall patterns form from modulated phases, Cell, 2019, 176: 856-868.
2、Radja A. Pollen wall patterns as a model for biological self-assembly, J. Exp. Zool. (Mol. Dev. Evol.). 2020, 1-13.
3、An, X.; Ma, B.; Duan, M.; Dong, Z.; Liu, R.; Yuan, D.; Hou, Q.; Wu, S.; Zhang, D.; Liu, D.; Yu, D.; Zhang, Y.; Xie, K.; Zhu, T.; Li, Z.; Zhang, S.; Tian, Y.; Liu, C.; Li, J.; Yuan, L. and Wan, X. Molecular regulation of ZmMs7 required for maize male fertility and development of a dominant male-sterility system in multiple species, PNAS, 2020, 117: 23499-23509.
4、Jiang, Y.; An, X.; Li, Z.; Yan, T.; Zhu, T.; Xie, K.; Liu, S.; Hou, Q.; Zhao, L.; Wu, S.; Liu, X.; Zhang, S.; He, W.; Li, F.; Li, J. and Wan, X. CRISPR/Cas9-based Discovery of Maize Transcription Factors Regulating Male Sterility and Their Functional Conservation in Plants, Plant Biotechnol. J., 2021, 19: 1769-1784.
5、Yang, C.; Vizcay-Barrena, G.; Conner, K. and Wilson, Z. A. MALE STERILITY1 is required for tapetal development and pollen wall biosynthesis. The Plant Cell, 2007,19: 3530-3548.


