
Cell Communication and Signaling | 乳酸片球菌PA降低tau蛋白毒性和改善神经退行性模型机制
阿尔兹海默症(AD)是当今世界上最棘手的老年病之一,其病理上发病特征是与 Aβ 和 tau 蛋白的非正常聚集和修饰。越来越多的证据表明脑铁积累是阿尔茨海默病的一个重要特征。然而,铁介导的肠道-大脑轴对阿尔茨海默病的作用和机制仍不清楚。其次,肠道又被称为人体的“第二大脑”,广泛而多样的肠道菌群调控与人脑的代谢和生理活动密不可分,其可以调控肠道菌群从而改善宿主身体状态。当前,益生菌作为“活的微生物”已经受到食品界的重视,开发特种益生菌食品成为“吃饱”到“吃好”的关键途径之一。
2024年1月30日,北京科技大学生物农业研究院/北京中智生物农业国际研究院万向元教授团队/龙艳小组在国际学术期刊Cell communication and signaling(IF: 8.4)在线发表题为“Pediococcus acidilactici reduces tau pathology and ameliorates behavioral deficits in models of neurodegenerative disorders”的研究论文。该研究利用小鼠和线虫的双实验动物模型体系,验证了乳酸片球菌(PA)在体内抗铁诱导的神经退行性功效。PA的摄入延缓高铁饮食小鼠模型的认知障碍过程,减少脑铁积累、增强全身碱性磷酸酶(AP)活性、加速去磷酸化、降低磷酸盐水平并增加脑还原性尿酸的产生。同时PA喂养的带有痴呆tau蛋白线虫寿命更长,p-tau也相应下调。本研究为促进脑肠轴健康的食品开发提供了候选方案。

本文采用了高铁饲料对小鼠进行造模,并采用两种不同的益生菌(乳酸片球菌PA和枯草芽孢杆菌BN)进行灌喂。在实验结束前一周开展巴恩斯迷宫和Y字迷宫实验,用于检测两种益生菌对于高铁饮食小鼠短期记忆和长期记忆的改善情况。结果表明,只有摄入PA的小鼠肠炎得到改善,并在两种迷宫中表现出色(图1)。
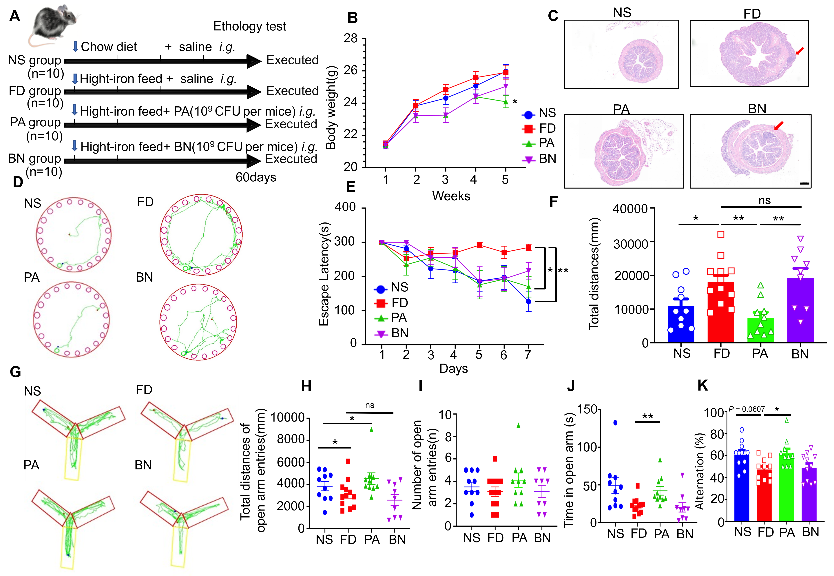
图1:PA的摄入改善高铁饮食后的空间学习和记忆以及肠道组织学
随后,作者通过WB,RT-qPCR等实验证明了PA的摄入可以降低小鼠海马和前额叶中tau蛋白的含量,然而对APP(Aβ蛋白前体)蛋白的影响却不显著。其次,在过表达p-tau蛋白的线虫中PA可以延长线虫的生存时间,并降低全身痴呆相关tau和p-tau蛋白的表达,并通过相关铁、磷酸转运体的转运来完成以上机制(图2)。
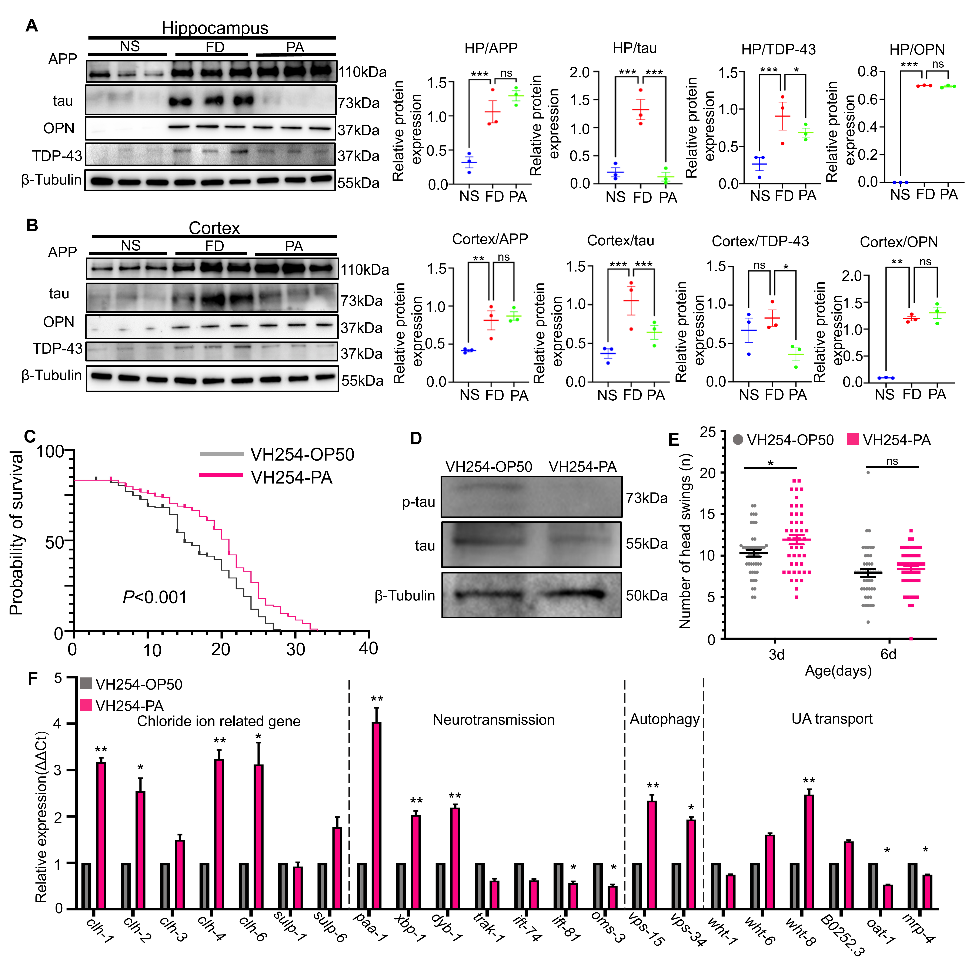
图2:PA 干预改变的AD风险蛋白表达以及在小鼠和线虫中降低 tau的效果
肠-脑轴的关键在于肠,不同肠段的功能差异较大。本文接下来研究了十二指肠和结肠中相关生理指标的变化,以确定链接“肠脑”的关键分子。有意思的是,十二指肠中slc22a17/lcn2的表达升高,结肠中FABP4和HIF-2α的表达升高。随后,通过测定磷酸、乳酸和铁的含量,明确了铁在AD系统中转运和传输的条件。
后续在海马和前额叶相关机制的研究中,文章发现PA 的干预会阻止前额叶中铁浓度的升高,增强了 AP 活性和 尿酸UA 水平,降低了铁转运蛋白DMT1、磷酸转运体slc20a1、slc20a2和缺氧诱导因子HIF-2α的蛋白水平。而在海马中PA可减少tau蛋白免疫反应的聚集,尤其是消除p-tau免疫反应,与对照组小鼠相比,Fe-die(FD)小鼠海马CA1、CA3和DG层的tau和p-tau免疫反应区增大,而灌喂PA可减少tau蛋白免疫反应的聚集,尤其是消除p-tau免疫反应。与 FD组的海马相比,高铁饮食条件下炎症 IL-1β 和 IL-6 增加,但PA海马中的 CD68 蛋白减少,但前额叶皮质中的 CD68 无显著变化。以上数据表明PA的治疗可能呈现一定的组织特异性(图3)。
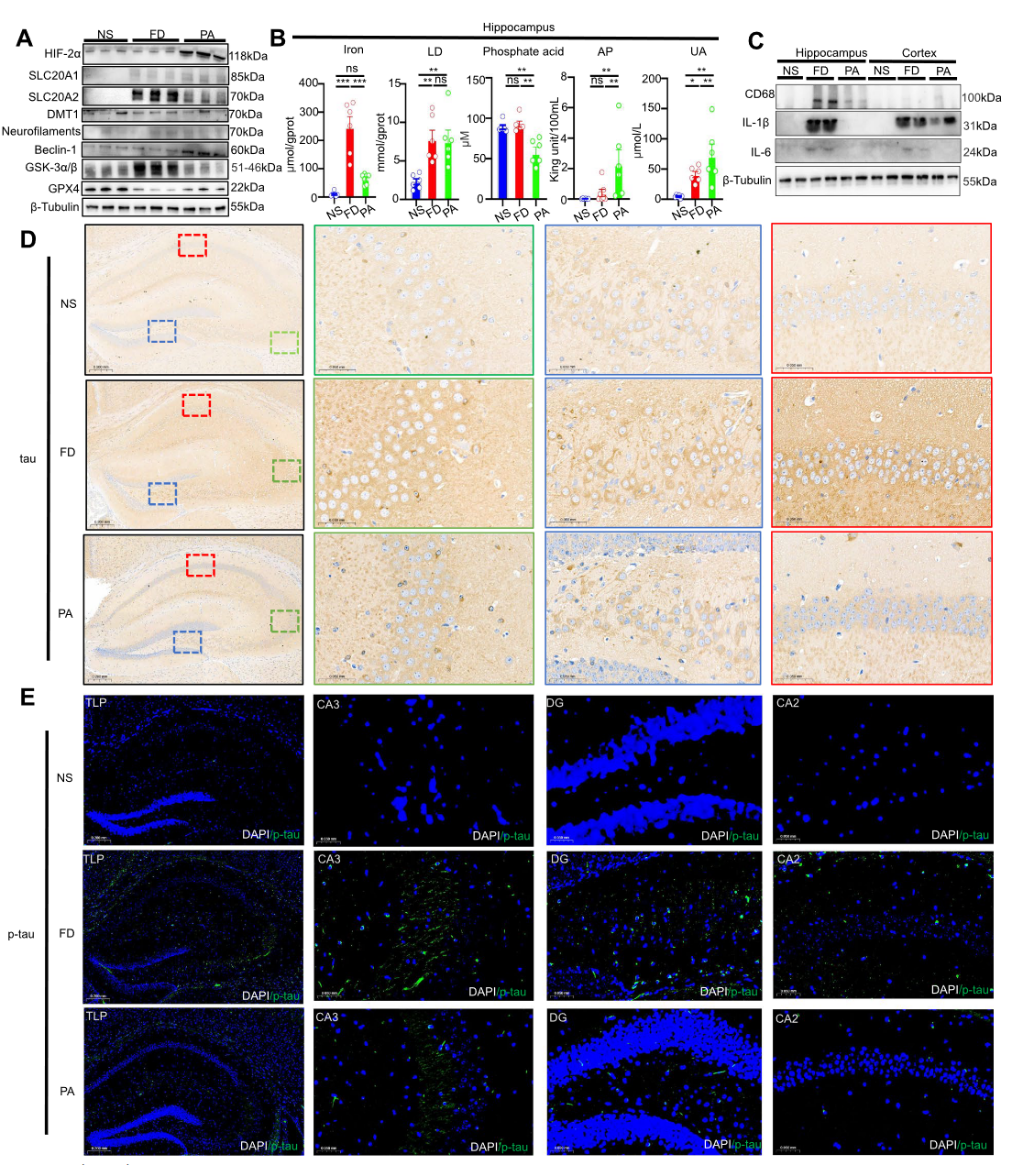
图3:高铁(FD)条件下PA对海马组织的效应
为了研究PA倒底是通过怎样的机制从肠道影响到大脑,文章进一步通过切片验证了海马中slc22a17的分布和表达,表明slc22a17聚集的部位和含量集中于认知关键部位。血清ELISA鉴定出几种表达明显变化的分子(碱性磷酸酶AP、LCN2、磷酸、尿酸和LBD)。结果表明PA显著提高了AP和UA水平,降低了循环中内毒素结合蛋白LBP、铁转运体LCN2和磷酸的水平(图4)。在过表达 tau的线虫中,还原剂UA的回补了起到了延长寿命的作用,表明 UA 在减轻毒性tau中发挥了有益的作用。
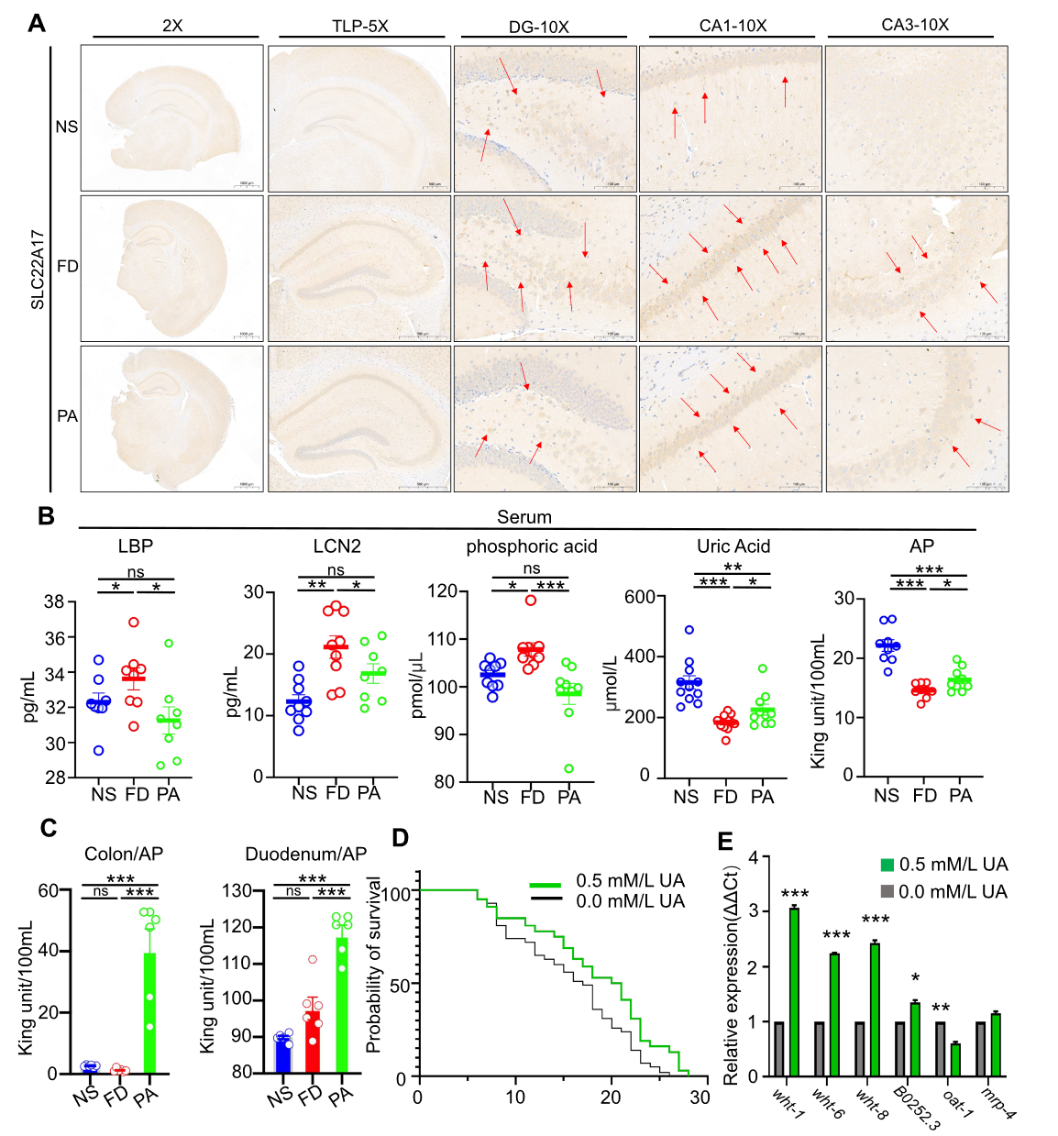
图4:海马组织中slc22a17的分布和表达
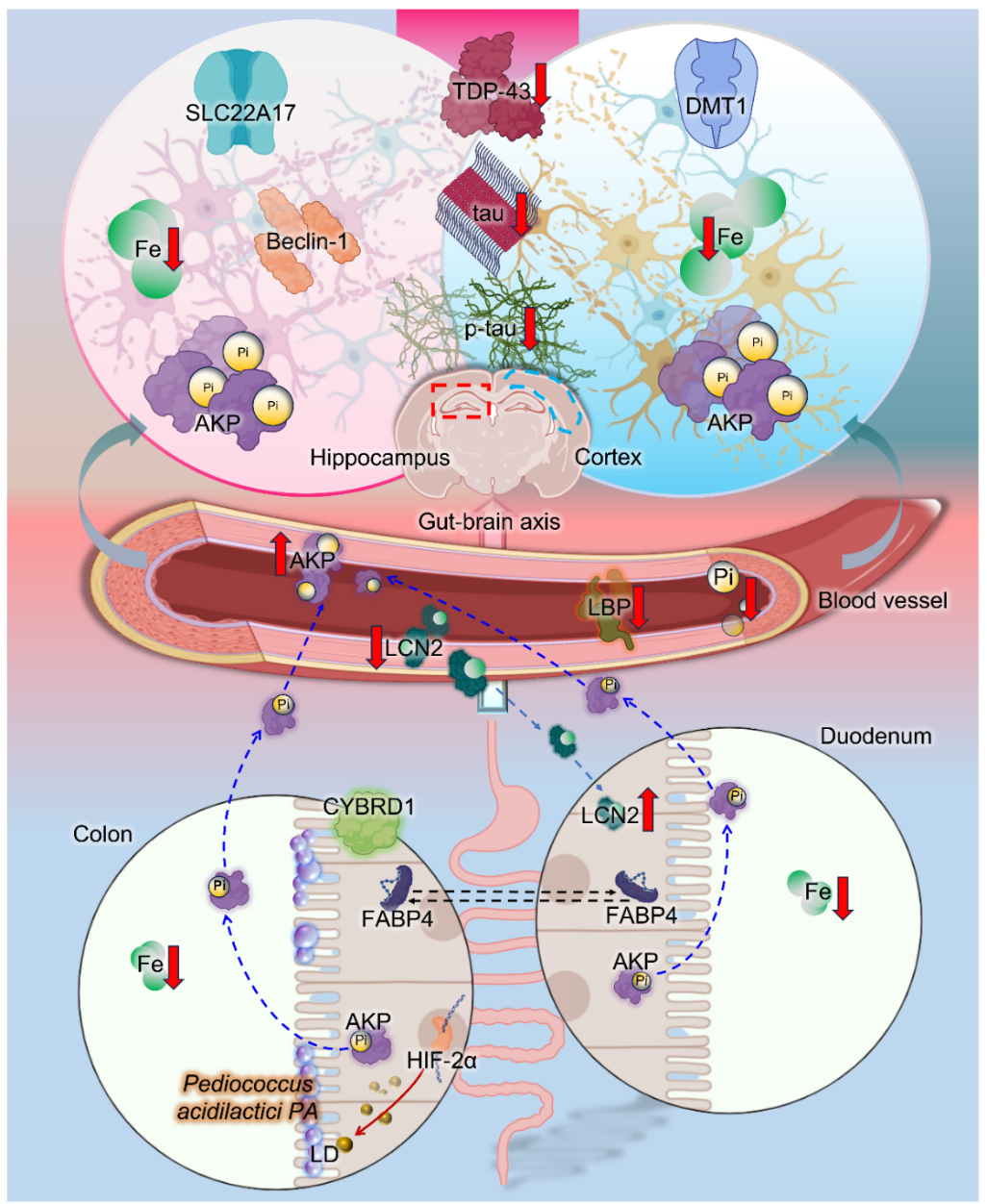
图5:PA改善脑铁痴呆可能的机制模型
综上,文章数据表明PA的摄入改善了高铁饲养小鼠的认知障碍,PA是减少 tau 蛋白的表达和激活 AP 的重要介质。PA 通过影响结肠中乳酸介导的 HIF-2α 信号传导来改善铁潴留,但不影响大脑,从而影响十二指肠和大脑中的 LCN2。全身的AP 活性的增加降低了大脑中系统性磷酸水平和 tau 磷酸化(图5)。文章发现十二指肠-脑转运轴和结肠-脑AP轴的拓展是AD病理中tau蛋白清除和炎症通路的机制基础。这些结果可能会为了解 AD 及其相关并发症的病理生物学提供重要启示。
北京科技大学生物农业研究院、北京中智生物农业国际研究院等单位讲师张勇、已毕业硕士生钱伟祎和张艺彤为该论文共同第一作者,万向元教授和龙艳教授为通讯作者。该研究获得了国家重点研发计划和佛山科技创新基金的资助。
原文链接:https://doi.org/10.1186/s12964-023-01419-3


